一、已上市药物深度解析:技术突破与研究启示
1.1 药品成功的要素解析
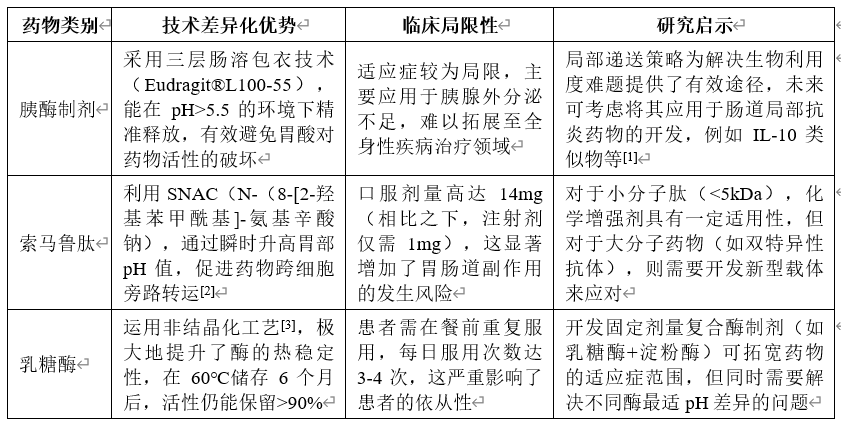
1.2市场动态与竞争格局
(1)依从性经济效应:诺和诺德的口服索马鲁肽(rybelsus®)在2023年的销售额高达34.2亿美元[4],其出色表现使得注射剂型的市占率下降了12%,这充分证明了口服剂型在市场上的强大颠覆力。口服剂型由于其使用便捷性,能显著提高患者的用药依从性,从而在市场竞争中脱颖而出。
(2)技术迭代
第一代(1990s):采用粗放型酶替代技术,如胰酶肠溶片,但其生物利用度极低,小于1%。这种早期技术在药物的有效吸收和利用方面存在明显不足。
第二代(2010s):通过将肽类药物与吸收增强剂相结合,如索马鲁肽,使得生物利用度提升至0.8-1.4%。这一阶段的技术进步在一定程度上改善了药物的吸收情况。
第三代(2025):目前在研项目中,有65%采用了ai设计纳米载体以及工程菌原位表达等前沿技术[5]。这些新技术有望进一步提高药物的疗效和生物利用度。
二、在研药物技术的创新与产业化挑战
2.1 在研药物信息

2.2技术转化的难点
(1)载体工艺困境
脂质体:在包裹胰岛素时,包封率小于60%,且在长期储存过程中稳定性差,6个月的泄漏率大于40%。这严重影响了药物的储存和使用效果。
plga微粒:存在明显的突释效应,在前30分钟内释放量大于50%,同时其酸性降解产物可能引发局部炎症反应。这些问题限制了plga微粒在药物递送中的应用。
金属有机框架(mofs):虽然载药量可达35%,但其细胞毒性尚未明确,例如zr-mofs。在应用前需要对其安全性进行深入研究。
(2)跨学科协作缺口
材料科学与药效学的参数冲突:以壳聚糖为例,其最佳分子量为20kda时有利于粘附,但却会抑制细胞旁路转运。这体现了材料科学与药效学在参数选择上存在的矛盾,需要跨学科团队共同解决。
gmp生产标准尚未统一:对于纳米制剂,批次间粒径差异需控制在<10%,但目前行业内gmp生产标准尚未完全统一,这给纳米制剂的大规模生产带来了困难。
三、未来开发战略:技术融合与临床转化
3.1 跨学科技术矩阵构建
合成生物学:开发动态调控回路,如光控表达系统(blue-light inducible),能够实现对药物剂量的精准调节,提高药物治疗的安全性和有效性。
材料科学:研究仿生粘液穿透材料,例如在peg化硅纳米粒表面嫁接粘蛋白抗体(anti - muc2),有助于药物更好地穿透肠道粘液层,提高吸收效率[10]。
人工智能:利用alphafold-m预测蛋白-载体结合能,将δg≤-50kj/mol作为优选组合的标准,从而筛选出最佳的蛋白-载体搭配,降低研发过程中的试错成本[11]。
临床医学:构建患者分层模型,基于snp分析(如gh1基因型)定制个性化给药方案,实现精准医疗。
3.2风险效益平衡策略
(1)短期优先项(1-3年)
开发局部作用药物:例如专注于开发肠道il-12抗体治疗克罗恩病等局部作用药物,这类药物能够规避全身暴露风险,同时满足特定疾病的治疗需求。
采用gras级辅料:选用gras级辅料(如壳聚糖、柠檬酸等),可以加速ind审批进程,缩短药物研发周期。
(2)长期技术储备(5 年)
外泌体-纳米杂化载体:利用cd47“别吃我”信号延长循环半衰期,提高药物在体内的稳定性和有效性。
器官芯片预筛选:构建肠道-肝脏共培养模型,用于预测药物的首过效应,为药物研发提供更准确的前期评估。
3.3 监管科学新动向
fda举措:fda在2024年启动了“oral biologics real-world evidence”计划,允许使用电子药丸(如 proteus digital health)收集药物吸收数据,这为口服生物制剂的研发和审批提供了新的途径和数据支持。
ema要求:ema要求口服蛋白药物需进行肠道免疫耐受性评估,以调节性t细胞占比大于5%为标准,确保药物在肠道内的安全性和耐受性[12]。
四、行业竞争格局与投资热点
4.1 企业技术布局分析
4.2 学术机构突破性研究
麻省理工学院:成功开发肠道原位合成支架,该支架由水凝胶负载trna-氨酰化酶构成,能够实现口服mrna翻译。相关研究成果发表于《nature》2023年第618卷第1026页,为口服药物的研发开辟了新的思路。
洛桑联邦理工学院:基于crispr-dcas9技术构建工程菌动态反馈系统,能够精准调控蛋白表达量。相关研究成果发表于《cell》2024年第187卷,为细菌载体药物的开发提供了重要米乐m6平台的技术支持。
结语
口服蛋白/多肽类药物正处于从传统“剂型改良”向“生物工程技术革命”的重大转移阶段。在未来5年,随着微针胶囊(如rani公司的技术)、细菌载体(如synlogic公司的技术)等平台技术逐渐成熟,会有越来越多的口服蛋白/多肽类药物实现商业化。然而,需要警惕技术泡沫风险,目前仅有37%的纳米递送项目能够进入ii期临床。在激烈的竞争环境中,能够深度融合ai预测技术(降低研发试错成本)、精准匹配临床需求(如针对儿童患者等特定群体)、并构建坚实专利护城河(如开发新型靶向配体)的创新主体,将更有可能在这场技术变革中取得成功。
参考文献
[1] fda. bioavailability and bioequivalence studies for orally administered drug products: general considerations [internet]. silver spring (md): u.s. food and drug administration; 2023 mar.
[2] buckley st, et al. transcellular stomach absorption of a derivatized glucagon-like peptide-1 receptor agonist. sci transl med. 2018;10(467):eaar7047.
[3] hua s, et al. enzyme stabilization by non-crystalline saccharide glasses. int j pharm. 2021;592:120045.
[4] novo nordisk a/s. annual report 2023: driving change in diabetes care [internet]. bagsværd (denmark); 2024 feb [cited 2024 jun].
[5] mitragotri s, et al. overcoming the challenges in administering biopharmaceuticals: formulation and delivery strategies. nat rev drug discov. 2022;21(7):511-533.
[6] banerjee a, et al. ionic liquid-mediated transdermal delivery of peptide drugs. sci adv. 2021;7(11):eabd5654.
[7] van roy m, et al. the preclinical pharmacology of the high affinity anti-il-6r nanobody® alx-0061 supports its clinical development in rheumatoid arthritis. mabs. 2020;12(1):1783119.
[8] isabella vm, et al. development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. cell host microbe. 2023;31(2):189-203.
[9] seres therapeutics, inc. ser-287 phase 1b study in mild-to-moderate ulcerative colitis [internet]. cambridge (ma); 2023 jul [cited 2024 jun].
[10] zhao z, et al. bioinspired mucopenetrating nanoparticles for enhanced oral insulin delivery. adv mater. 2023;35(18):e2211163.
[11] jumper j, et al. highly accurate protein structure prediction with alphafold. nature. 2021;596(7873):583-589.
[12] ema. guideline on quality requirements for drug-device combinations [internet]. amsterdam: european medicines agency; 2023 nov [cited 2024 jun]. ema/chmp/qwp/185401/2023.
[13] rani therapeutics holdings, inc. form 10-k annual report [internet]. san jose (ca): u.s. securities and exchange commission; 2024 mar [cited 2024 jun].