随着全球医药行业的快速发展,新药研发与创新已成为推动行业进步的重要动力。近期,根据摩熵医药数据统计,新药申请与审批获批频繁,显示出医药创新领域的活跃态势。

本文将深入分析2025年8月18日至2025年8月24日期间,国内外新药申请、临床试验批准、仿制药一致性评价等多个方面的最新进展,为用户提供全面的行业资讯。
根据摩熵医药数据库统计,2025年8月18日至8月24日期间共有79个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(cde)承办(按受理号统计,不含补充申请)。其中国产药品受理号62个,进口药品受理号17个。
本周共计87款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药42款,生物药40款,中药5款。
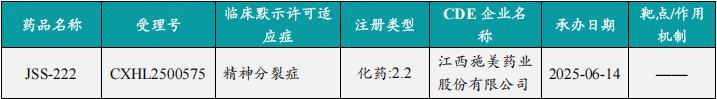
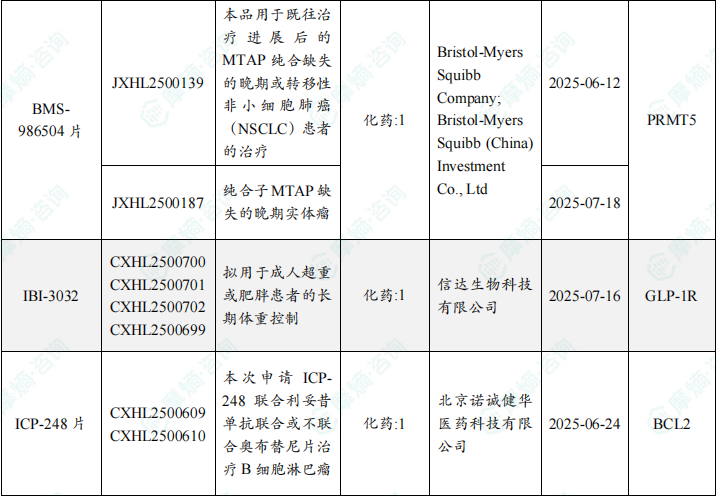
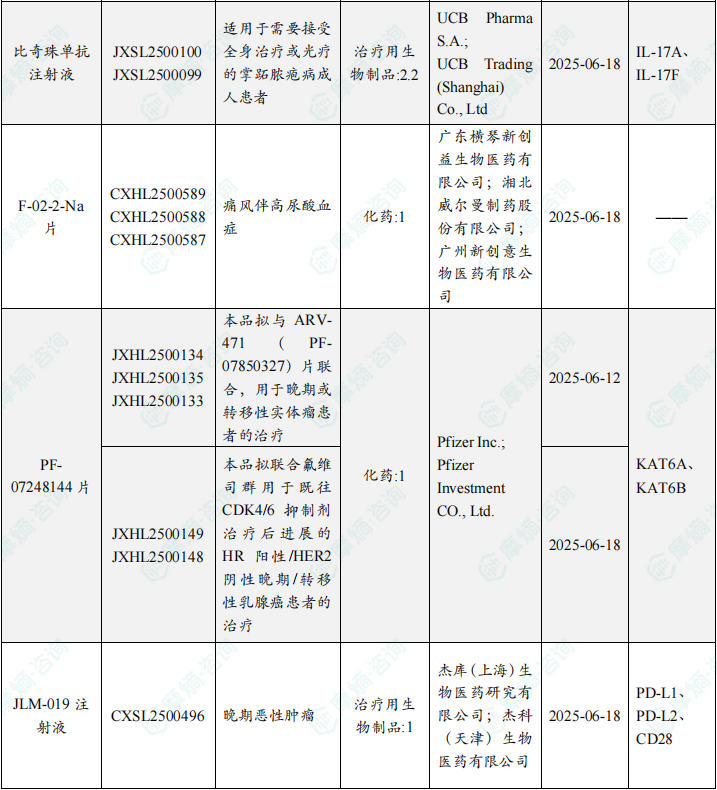
注:完整数据可识别“文末”二维码下载查看
在全球创新药研发领域,8月18日,华奥泰生物宣布,瑞西奇拜单抗(研发代号:hb0034)注射液被中国国家药监局药品审评中心(cde)纳入优先审评,拟用于治疗成人泛发性脓疱型银屑病(gpp)发作。
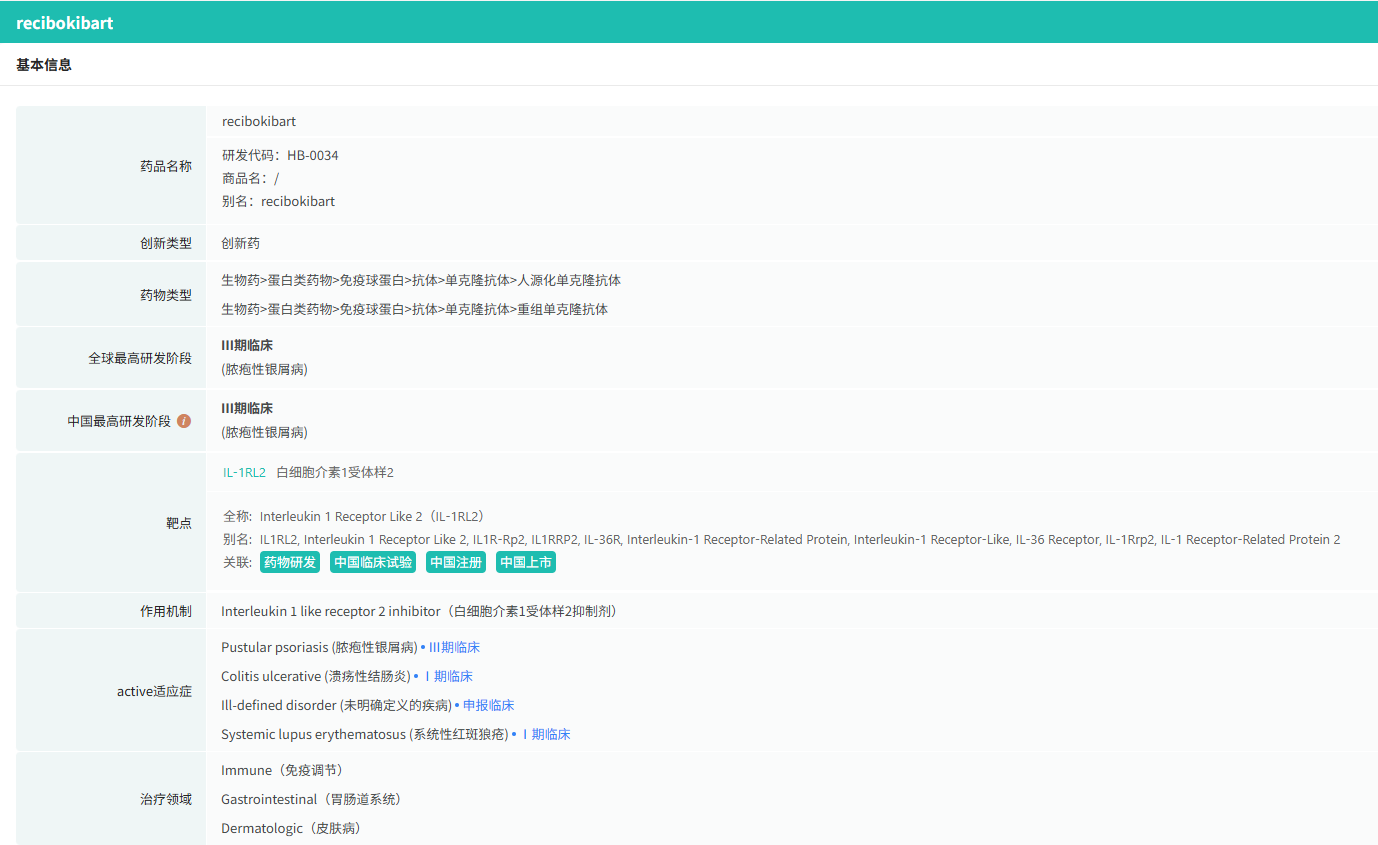
截图来源:摩熵医药全球药物研发数据库
8月20日,国家药品监督管理局(nmpa)药品审评中心(cde)米乐m6平台官网显示,阿斯利康的阿伏利尤单抗注射液上市申请已获受理,用于治疗系统性红斑狼疮(sle)。
阿伏利尤单抗是一款first-in-class全人源单克隆抗体,靶向i型干扰素受体1(ifnar1),从而阻断i型干扰素的活性。ifnar1与ifnar2可形成异二聚体受体(ifn-α/β 受体),是参与调控sle炎症通路的细胞因子,在其病理生理学中起着核心作用,i型干扰素受体信号的增加与疾病活动度和严重程度增加相关。2021年8月,阿伏利尤单抗首次获得fda批准,用于治疗正在接受标准治疗的中度至重度系统性红斑狼疮成人患者。多项注册性临床研究数据(包括iii期tulip-1、tulip-2研究和ii期muse研究)表明,与安慰剂相比,在标准治疗基础上,阿伏利尤单抗组更多患者实现器官系统(包括皮肤和关节)的整体疾病活动度减少,同时口服皮质类固醇(ocs)的使用也持续减少。
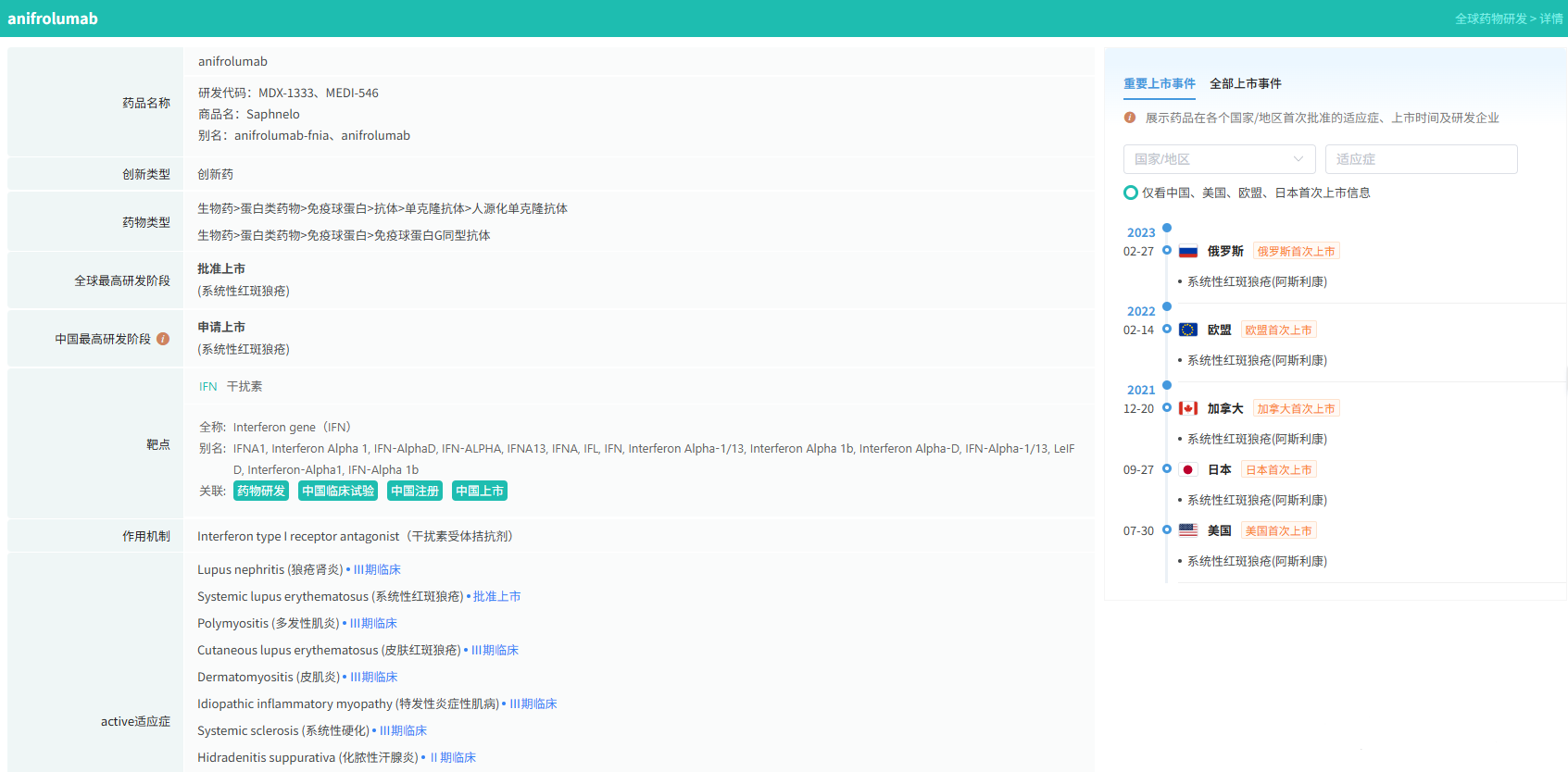
同日(8月20日),据cde米乐m6平台官网公示,爱科百发的齐瑞索韦肠溶胶囊上市申请已获受理,根据注册临床研究数据,推测其适应症为:用于由呼吸道合胞病毒(rsv)引起的2岁及以下儿童呼吸道感染的治疗;恩华药业的nh600001乳状注射液上市申请已获受理,根据其注册性临床研究进展,推测此次申报的适应症为用于胃镜和结肠镜诊疗镇静/麻醉;诺华(novartis)宣布创新产品盐酸阿曲生坦片获得中国国家药品监督管理局(nmpa)批准,用于降低有疾病快速进展风险的原发性免疫球蛋白a肾病(iga肾病,igan)成人患者的蛋白尿。(相关详情请点击:)
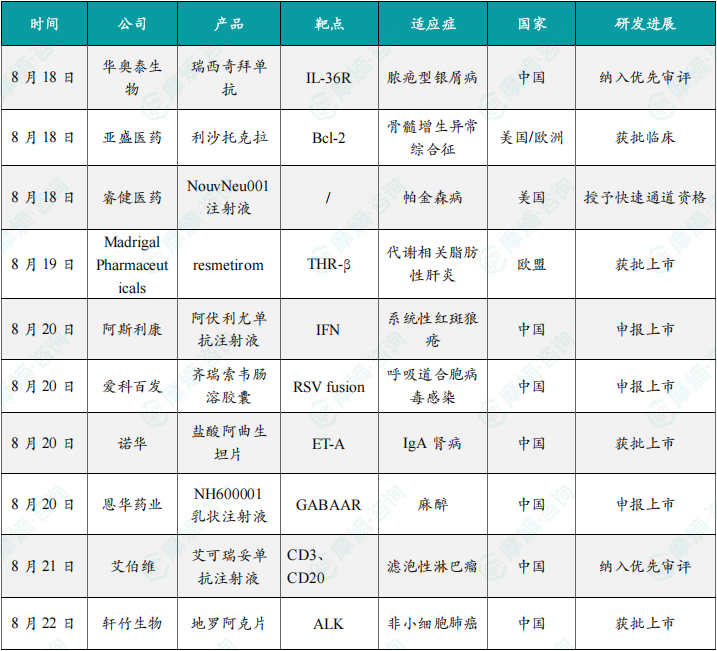
截图来源:摩熵咨询周报
本周全球多项临床试验结果亮点纷呈,其中8月18日,2025年世界肺癌大会(wclc)的常规摘要正文正式公布。
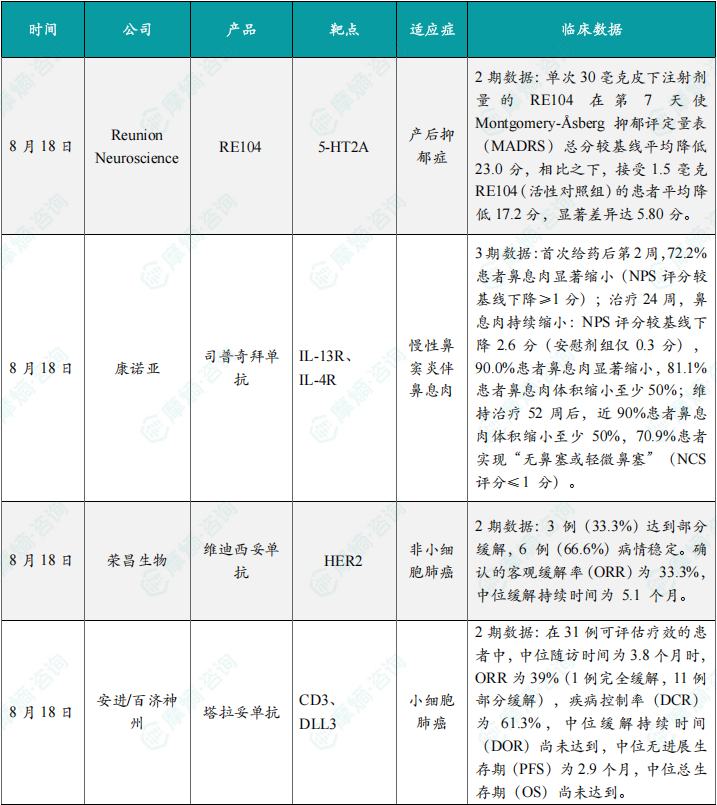
荣昌生物维迪西妥单抗联合其它药物治疗肺癌的ii期临床数据在本次会议上进行了展示。本次wclc上公布的是一项单臂 ii 期临床试验 resolution(nct06749860)的数据,研究旨在评估维迪西妥单抗联合替雷利珠单抗及贝伐珠单抗用于her2突变/扩增/表达的局部晚期或转移性非小细胞肺癌的疗效和安全性。共28名符合条件的患者将接受维迪西妥单抗(2.0 mg/kg)、替雷利珠单抗(200 mg)和贝伐珠单抗(7.5 mg/kg)治疗,每3周静脉注射一次,直至病情进展或出现不可接受的毒性。从2024年4月至2025年1月,共入组11例患者,其中9例可评估疗效。在这些患者中,3例(33.3%)达到部分缓解,6例(66.6%)病情稳定。确认的客观缓解率(orr)为 33.3%,中位缓解持续时间为 5.1 个月。
截图来源:摩熵医药全球药物研发数据库
综上,研究认为:维迪西妥单抗 替雷利珠单抗 贝伐珠单抗联合疗法是her2基因突变型非小细胞肺癌 (nsclc) 的一种有前景的治疗策略,支持进一步研究。
与此同时,安进/百济神州的塔拉妥单抗(tarlatamab)三线治疗广泛期小细胞肺癌(es-sclc)的中国ii期dellphi-307研究数据也揭开面纱。
该研究是一项单臂临床试验(n=32),评估了塔拉妥单抗治疗接受过至少二线治疗(包括含铂化疗)后失败的es-sclc中国患者的疗效、安全性以及耐受性。研究的主要终点为客观缓解率(orr)。该研究在今年5月达到主要终点。百济神州和安进已基于此向国家药监局递交塔拉妥单抗的上市申请。结果显示,在31例可评估疗效的患者中,中位随访时间为3.8个月时,orr为39%(1例完全缓解,11例部分缓解),疾病控制率(dcr)为61.3%,中位缓解持续时间(dor)尚未达到,中位无进展生存期(pfs)为2.9个月,中位总生存期(os)尚未达到。
截图来源:摩熵医药全球药物研发数据库
塔拉妥单抗是一款由安进研发的cd3/dll3双抗药物,能够同时结合肿瘤细胞上的dll3蛋白和t细胞上的cd3蛋白,进而激活t细胞杀伤表达dll3蛋白的肿瘤细胞,通过形成溶细胞突触诱导肿瘤细胞裂解。
根据摩熵医药数据库统计,2025年8月18日至8月24日期间共有103项仿制药申报上市/申报临床获cde承办,其中新注册分类上市申请受理号94项(包括化药3类,4类,5.2类),新注册分类临床申请受理号1项(包括化药3类),一致性评价申请8项。本周4个品种通过一致性评价(按受理号计4项),本周无品种视同通过一致性评价。本周有2项生物类似物注册申报动态,分别是安科生物的注射用曲妥珠单抗和派金生物科技的pj-021注射液。
本周过评/视同过评品种包括血液和造血系统药物、消化系统与代谢药物、神经系统药物和全身用激素类制剂(不含性激素和胰岛素);过评/视同过评产品剂型均为片剂;本周各品种过评/视同过评受理号数量均为1个,本周各品种过评/视同过评企业均为1家;各企业过评/视同过评品种数均为1种,本周过评/视同过评企业共包括天方药业有限公司、中峘本草制药有限公司、沈阳福宁药业有限公司和浙江仙琚制药股份有限公司4家企业。